MINIANMELDELSE
Utposten mot kreft: universelle kreftmarkører
Chengchen Qian1, Xiaolong Zou2, Wei Li1,3, Yinshan Li4, Wenqiang Yu5
1Shanghai Epiprobe Biotechnology Co., Ltd, Shanghai 200233, Kina;2 Department of General Surgery, det første tilknyttede sykehuset ved Harbin Medical University, Harbin 150001, Kina;3Shandong Epiprobe Medical Laboratory Co., Ltd, Heze 274108, Kina;4 People's Hospital of Ningxia Hui autonome region, Ningxia Medical University, Yinchuan 750002, Kina;5Shanghai Public Health Clinical Center & Department of General Surgery, Huashan Hospital & Cancer Metastasis Institute & Laboratory of RNA Epigenetics, Institutes of Biomedical Sciences, Shanghai Medical College, Fudan University, Shanghai 200032, Kina
ABSTRAKT
Kreft er den ledende dødsårsaken på verdensbasis.Tidlig oppdagelse av kreft kan senke dødeligheten av alle typer kreft;imidlertid mangler effektive biomarkører for tidlig oppdagelse for de fleste typer kreft.DNA-metylering har alltid vært et hovedmål av interesse fordi DNA-metylering vanligvis skjer før andre påvisbare genetiske endringer.Mens de undersøkte de vanlige egenskapene til kreft ved å bruke en ny veiledningsposisjoneringssekvensering for DNA-metylering, har en serie universelle markører for kreft (UCOM) dukket opp som sterke kandidater for effektiv og nøyaktig tidlig oppdagelse av kreft.Mens den kliniske verdien av nåværende kreftbiomarkører reduseres av lav sensitivitet og/eller lav spesifisitet, sikrer de unike egenskapene til UCOM-er klinisk meningsfulle resultater.Validering av det kliniske potensialet til UCOM-er i lunge-, livmorhals-, endometrie- og urotelkreft støtter ytterligere anvendelsen av UCOM i flere krefttyper og ulike kliniske scenarier.Faktisk er applikasjonene til UCOM-er for tiden under aktiv etterforskning med ytterligere evaluering i tidlig påvisning av kreft, hjelpediagnose, behandlingseffektivitet og tilbakefallsovervåking.De molekylære mekanismene som UCOM-er oppdager kreft er de neste viktige temaene som skal undersøkes.Bruken av UCOM-er i virkelige scenarier krever også implementering og foredling.
SØKEORD
Kreft påvisning;kreft screening;DNA-metylering;kreft epigenetikk;kreft biomarkører
Hvorfor vi trenger nytt sårt biomarkører?
Etter å ha bekjempet kreft i over et århundre, er kreft fortsatt den mest dødelige biologiske trusselen mot menneskeheten.Kreft er fortsatt et globalt helseproblem med 19,3 millioner nye tilfeller og nesten 10 millioner dødsfall estimert i 20201. I 2020 ble anslagsvis 4,6 millioner nye tilfeller av kreft diagnostisert i Kina, noe som utgjør 23,7 % av nye krefttilfeller globalt ifølge GLOBOCAN1.Videre ble omtrent 3 millioner dødsfall tilskrevet kreft i Kina i 2020, som var 30 % av globale kreftrelaterte dødsfall1.Denne statistikken indikerte at Kina rangerer først når det gjelder forekomst og dødelighet av kreft.Videre er 5-års kreftoverlevelsesraten 40,5 %, som er 1,5 ganger lavere enn 5-års overlevelsesraten i USA2,3.Den relativt lavere overlevelsen og høyere dødeligheten i Kina enn i land med høyere menneskelige utviklingsindekser antyder at et effektivt og kostnadseffektivt kreftforebyggings- og overvåkingssystem er et presserende behov.Tidlig oppdagelse av kreft er en av de mest kritiske elementene i et helsevesen.Tidlig påvisning av kreft kan forbedre prognosen og overlevelsen på et tidlig stadium i nesten alle krefttyper4.Vellykkede screeningsstrategier har ført til en betydelig nedgang i forekomsten og dødeligheten av livmorhals-, bryst-, tykktarms- og prostatakreft.
Å oppnå en tidlig oppdagelse av kreft er imidlertid ikke en lett oppgave.Å undersøke biologien og prognosen til tidlig kreft, identifisere og validere pålitelige biomarkører for tidlig oppdagelse og utvikle tilgjengelige og nøyaktige teknologier for tidlig deteksjon har alltid vært de største hindringene i prosessen4.Nøyaktig påvisning av kreft kan skille godartede fra ondartede lesjoner, noe som bidrar til å unngå unødvendige prosedyrer og letter videre sykdomsbehandling.Gjeldende tidlige deteksjonsstrategier inkluderer endoskopbaserte biopsier, medisinsk bildebehandling, cytologi, immunoassays og biomarkørtester5-7.Endoskopbaserte biopsier er påtrengende og kostbare og bærer en iboende tung byrde som en stor medisinsk prosedyre som er avhengig av profesjonelt personell.I likhet med cytologi er begge screeningsmetodene avhengige av medisinsk fagpersonell og er basert på personlig vurdering med en ytelse som er langt fra ideell8.I motsetning til dette er immunoassays svært unøyaktige, gitt de høye falske positive frekvensene.Medisinsk bildebehandling, som en screeningstaktikk, krever dyrt utstyr og spesialiserte teknikere.Derfor er medisinsk bildebehandling ekstremt begrenset på grunn av den lave tilgjengeligheten.Av alle disse grunnene ser biomarkører ut til å være et bedre alternativ for tidlig oppdagelse av kreft.
Korrespondanse til: Yinshan Li og Wenqiang Yu
Email: liyinshan@nxrmyy.com and wenqiangyu@fudan.edu.cn
ORCID ID: https://orcid.org/0009-0005-3340-6802 og
https://orcid.org/0000-0001-9920-1133
Mottatt 22. august 2023;akseptert 12. oktober 2023;
publisert på nett 28. november 2023.
Tilgjengelig på www.cancerbiomed.org
©2023 Kreftbiologi og medisin.Creative Commons
Attribution-NonCommercial 4.0 International License
Biomarkører er for tiden kategorisert som proteiner, DNA-mutasjonsmarkører, epigenetiske markører, kromosomavvik, RNA-markører avledet direkte fra svulster, eller tumorfragmenter hentet indirekte fra kroppsvæsker.Proteinmarkører er de mest brukte biomarkørene i kreftscreening og diagnose.Proteinbiomarkører, som screeningsbiomarkører, er begrenset av tendensen til å bli påvirket av godartede lesjoner, noe som fører til overdiagnostisering og overbehandling, slik det er rapportert for α-fetoprotein og prostataspesifikt antigen (PSA)9,10.RNA-markører inkluderer genetiske ekspresjonsmønstre og andre ikke-kodende RNA-markører. En kombinasjon av genetiske ekspresjons-RNA-markører kan påvises ved bruk av urinprøver, hvis sensitivitet var langt fra tilfredsstillende (60 %) for primærtumorer, og påvisningen av disse kan bli påvirket av den enkle nedbrytningen av RNA i det normale miljøet11.Genetiske og epigenetiske markører står begge overfor problemet med prevalens i svulster og begrensning til krefttyper.
DNA-metylering har vært en sterk kandidat som biomarkør for tidlig påvisning siden den første gang ble koblet til kreft av Feinberg i 198312. DNA-metyleringsavvik observeres i alle stadier av kreft, så tidlig som i det precancerøse stadiet.Avvikende DNA-hypermetylering finner vanligvis sted på CpG-øyer i genpromotere for å motvirke tumorsuppressorer13,14.Studier har også antydet at unormal DNA-hypermetylering engasjerer seg i oppregulering av utviklingsregulatorer15.DNA-metyleringsdalen, som ofte er assosiert med utviklingsregulatorer og hypermetylerte kreftformer, kan bytte genekspresjonsmodus til en mer stabil DNA-metyleringsavhengig modus og redusere forbindelsen til metylert histon H3K27me3 og assosierte polykamproteiner16,17.
Blant det store antallet publiserte DNA-metyleringsmarkører har flere med suksess debutert på markedet;Imidlertid har de nåværende kommersialiserte DNA-metyleringsmarkørene og diagnostiske panelene ennå ikke fullt ut låst opp potensialet for tidlig oppdagelse av kreft av flere årsaker18.Mens de stort sett viser akseptabel ytelse ved bruk av databaseinformasjon, fungerer disse biomarkørene vanligvis mindre ideelt i den virkelige verden på grunn av det faktum at prøver fra den virkelige verden ofte er mer komplekse og ikke like representative som de som er valgt i databasene.Neste generasjons sekvenseringsbasert multi-kreft-metylering tidlig påvisning har vist seg å ha kun 16,8 % og 40,4 % følsomhet i henholdsvis stadium I og II kreft19.Tidlige deteksjonstester krever større stabilitet og mer nøyaktige biomarkører.
Universal cancer only markør (UCOM) oppdagelse ved bruk av guideposisjonssekvensering (GPS)
Til tross for tiår med kreftforskning, har ikke tilfredsstillende forebygging og behandling blitt realisert.Nye metoder er nødvendige for å gjøre forskere i stand til å evaluere kreft grundig.I løpet av de siste 23 årene har 6 kreftkjennetegn, som å unngå apoptose, vevsinvasjon og metastaser, etc., blitt utvidet til 14 ved å inkludere funksjoner som ikke-mutasjons epigenetisk omprogrammering og polymorfe mikrobiomer20,21.Etter hvert som flere detaljer som involverer kreft avdekkes, introduseres flere perspektiver i kreftforskningen.Kreftforskningen har gradvis kommet inn i en nyere tid i to retninger (fellesskap og individualitet).Med utviklingen av presisjonsonkologi de siste årene, er fokuset for kreftforskning rettet mot individualisert målrettet terapi og heterogeniteten til kreft22.Derfor har nylig identifiserte kreftbiomarkører hovedsakelig fokusert på spesifikke krefttyper, slik som PAX6 kreftkreft23 og BMP3 for tykktarmskreft24.Ytelsen til disse biomarkørene som er spesifikke for krefttyper varierer, men det er fortsatt ikke mulig for mottakelige individer å gjennomgå screening for alle kreftformer samtidig på grunn av begrensningen av biologisk prøveinnsamling og de høye kostnadene.Det ville være ideelt om vi kunne identifisere en enkelt, robust biomarkør som er effektiv for alle typer kreft på et tidlig stadium.
For å oppnå et slikt ideelt mål må en bedre biomarkørkandidat velges fra listen over potensielle biomarkørtyper.DNA-metyleringsavvik, blant alle genetiske og epigenetiske profiler, er kjent for å være relatert til kreft og er noen av de tidligste, om ikke første, kreftrelaterte abnormitetene som oppstår kronologisk.Undersøkelsen av DNA-metylering startet tidlig, men har blitt hindret av mangel på forskningsmetoder.Blant 28 millioner potensielle metylerte CpG-steder i genomet, må et håndterbart antall oppdages og justeres til genomet for bedre å forstå tumorigenese.Helgenom-bisulfitt-sekvensering (WGBS), som anses å være gullstandarden for DNA-metyleringssekvensering, kan bare dekke 50 % av Cs i kreftceller på grunn av naturen til bisulfittbehandling som bryter DNA-fragmenter og senker genomkompleksiteten under transformasjonen av Cs-til-Ts25.Andre metoder, for eksempel 450 000 brikker, dekker bare 1,6 % av genommetyleringen.Basert på 450 000 data har et DNA-metyleringsdeteksjonspanel 35,4 % sensitivitet for 6 typer stadium I kreftformer26.Begrensninger av krefttyper, dårlig ytelse og støy generert av deteksjonsmetoder i den analytiske prosessen har blitt de største hindringene for pan-cancer deteksjonspaneler.
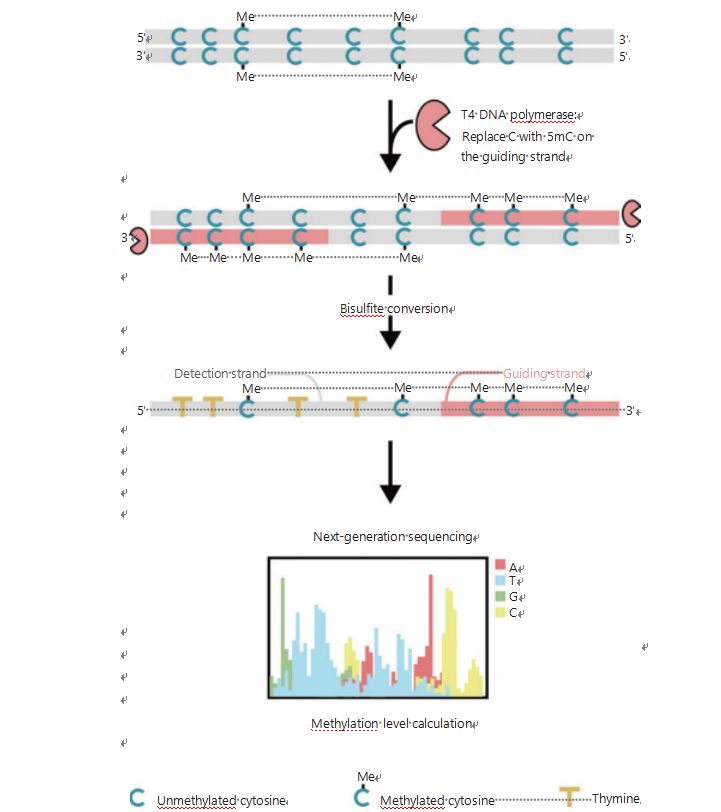
For bedre å undersøke de epigenetiske mønstrene til celler under tumorigenese og metastase, utviklet vi en unik GPS for genomomfattende DNA-metyleringsdeteksjon, som dekker opptil 96 % av CpG-stedene i 0,4 milliarder avlesninger25.GPS er en bilateral sekvenseringsmetode som bruker et 3'-ende av DNA-fragment av ikke-konverterbare metylcytosiner etter bisulfittbehandling som styrer justeringen av DNA-metyleringsberegning av 5'-enden gjennom parende sekvensering (figur 1)25.Den metyl-cytosin-ledende strengen, som fungerer som en malstreng, hjelper til med høy-GC-regionjustering som gjenoppretter de mest forlatte sekvenseringsdataene i tradisjonell WGBS.Den høye dekningsfunksjonen til GPS gir en enorm mengde DNA-metyleringsinformasjon, som lar oss undersøke kreftmetyleringsprofiler med en betydelig høyere oppløsning i tidligere lite undersøkte regioner.
GPS gir oss et kraftig verktøy for å undersøke homogeniteten til kreft, noe som i stor grad kan forenkle kreftforskning og potensielt finne en universell forklaring på svulst og metastaser.Mens man analyserte GPS-data for kreftcellelinjer, ble det ofte møtt et unikt fenomen.Det var en rekke regioner som så ut til å være unormalt hypermetylerte i flere typer kreftprøver.Dette uventede funnet ble deretter validert for å fungere som UCOM-er.Mer enn 7000 prøver fra 17 typer kreft i The Cancer Genome Atlas (TCGA) database har blitt analysert, blant annet identifiserte vi den første UCOM, HIST1H4F, et histonrelatert gen som er hypermetylert i alle typer kreft27.En serie UCOM-er ble deretter funnet og validert i TCGA-databasen, Gene Expression Omnibus-databasen (GEO) og kliniske prøver fra den virkelige verden.Per nå er HIST1H4F, PCDHGB7 og SIX6 funnet og validert som UCOM.Den uventede oppdagelsen av UCOM-er gir et kraftig svar på behovet for tidlig oppdagelse av kreft.UCOM gir en løsning for enkeltmarkørdeteksjon av flere kreftformer.
Kjennetegn på UCOM-er
Etter validering har UCOM-er vist seg å vise fire hovedegenskaper som gjør at UCOM-er kan overgå effektiviteten til gjeldende biomarkører (figur 2).
Unikt for malignitet
UCOM-er er unike for kreft- eller pre-kreftlesjoner og påvirkes ikke av normale fysiologiske endringer.Noen av de nåværende kreftrelaterte markørene som har blitt mye brukt i tidlig oppdagelse og/eller screening har ført til overdiagnostisering.Forhøyede PSA-nivåer, et klinisk akkreditert screeningsverktøy, oppdages også ved godartede tilstander, som prostatahyperplasi og prostatitt10.Overdiagnostiseringen og den resulterende overbehandlingen fører til redusert livskvalitet på grunn av tarm-, urin- og seksuelle komplikasjoner28.Andre proteinbaserte og mye brukte biomarkører i klinisk setting, som CA-125, har ikke gitt noen signifikante fordeler mens de har pådratt seg overdiagnostisering og overbehandling29.Den høye spesifisiteten til UCOM-er for maligniteter unngår disse manglene.UCOM, PCDHGB7, skiller effektivt høygradige plateepiteliale lesjoner (HSIL) og livmorhalskreft fra normale prøver og lavgradige plateepiteliale lesjoner (LSIL), mens de fleste andre biomarkører bare kan skille livmorhalskreft fra normale prøver30.Selv om PCDHGB7 ikke oppdager signifikante forskjeller mellom normal endometrium og endometriehyperplasi, oppdages signifikante forskjeller mellom normal endometrium og atypisk hyperplasi, og enda større forskjeller oppdages mellom normal endometrium og endometriekreft (EC) basert på PCDHGB731.UCOM-er er unike for ondartede lesjoner i databaser og kliniske prøver.Fra en pasients perspektiv reduserer unike UCOM-er terskelen for å forstå komplekse indikasjoner på ulike ustabile biomarkører med dårlig ytelse og den tilsvarende angsten under evalueringsprosessen.Fra klinikerens perspektiv skiller unike UCOM-er maligniteter fra benigne lesjoner, noe som hjelper til med triage av pasienter og reduserer unødvendige medisinske prosedyrer og overbehandling.Derfor reduserer unike UCOM-er redundans i medisinske systemer, avlaster systemets nød og gjør flere medisinske ressurser tilgjengelig for de som trenger det.
Figur 1 Skjematisk over GPS-arbeidsflyt for DNA-metyleringsdeteksjon25.Grå linje: inndata-DNA-sekvens;rød linje: DNA behandlet med T4 DNA-polymerase, erstatter cytosin med 5′-metylcytosin i 3′-enden av inngangen;blå C med Me: metylert cytosin;blå C: umetylert cytosin;gul T: tymin25.
Alt eller ingenting
UCOM er bare tilstede i kreftceller og oppdages stabilt i nesten alle kreftceller.HIST1H4F ble validert til å være hypermetylert i nesten alle tumortyper, men ikke i normale prøver27.Tilsvarende har PCDHGB7 og SIX6 også vist seg å være hypermetylert i alle tumorprøver, men ikke i normale prøver30-32.Denne unike egenskapen forbedrer ytelsen til UCOM-er betydelig med hensyn til grensen for deteksjon og følsomhet.Så få som 2 % av kreftcellene kan differensieres i prøver, noe som gjør UCOM-er til en mye mer sensitiv biomarkør enn de fleste eksisterende biomarkører30. Som en biomarkør som brukes til påvisning av tykktarmskreft, eksisterer KRAS-mutasjoner bare i omtrent 36 % av tilfellene av tykktarmskreft, tyder på dårlig diagnostisk potensial33.Den lave forekomsten av KRAS-mutasjoner i kolorektal kreft begrenser KRAS i kombinasjon med andre biomarkører.Faktisk kan en kombinasjon av biomarkører virke lovende i utgangspunktet, men genererer ikke alltid et tilfredsstillende resultat mens den viser mye større støy i deteksjonsanalyse og involverer vanligvis mer kompliserte eksperimentelle prosedyrer.Derimot eksisterer PCDHGB7 og andre UCOM-er i alle kreftformer.UCOM-er oppdager kreftkomponenter i forskjellige typer kreftprøver med ytterste presisjon samtidig som de eliminerer komplekse støyreduserende analyseprosesser.Det er ikke vanskelig å oppdage kreft i en rikelig prøve, men det er ekstremt utfordrende å oppdage kreft i en liten prøve.UCOM-er er i stand til å oppdage små mengder kreft.
Figur 2 Kjennetegn ved UCOM-er.
Kreftdeteksjon før patologiske endringer
UCOM-er kan oppdages i pre-kreftstadiet før patologiske endringer.Som epigenetiske biomarkører oppstår UCOM-avvik i et tidligere stadium enn fenotypiske abnormiteter og kan påvises gjennom tumorgenese, progresjon og metastaser34,35.Følsomheten til UCOM over tid forbedrer UCOM-ytelsen når det gjelder å oppdage tidlig stadium av kreft og pre-cancerøse lesjoner.Påvisning av tidlig kreft basert på biopsier og cytologi kan være vanskelig for selv de mest erfarne patologene.En enkelt biopsi oppnådd via kolposkopi er rapportert som positiv i 60,6 % av HSIL+ prøvene.Ytterligere biopsier er nødvendig for flere lesjoner for å øke følsomheten36.I motsetning til dette har UCOM, PCDHGB7, en sensitivitet på 82 % for HSIL+-prøver, og overgår sensitiviteten til biopsier og de fleste biomarkører30.Metyleringsmarkøren, FAM19A4, har en sensitivitet på 69 % for CIN2+, som ligner på cytologi, men kan ikke skille CIN1 fra normale prøver37.UCOM-er har vist seg å være en mye mer følsom biomarkør for tidlig deteksjon.Sammenlignet med erfaringsbaserte patologer har UCOMer overlegen deteksjonssensitivitet for kreft i tidlig stadium, noe som igjen bidrar til forbedret kreftprognose og overlevelse30.I tillegg tilbyr UCOM en deteksjonsplattform som er tilgjengelig for områder som mangler erfarne patologer og forbedrer deteksjonseffektiviteten betydelig.Med ensartede prøvetakings- og deteksjonsprosedyrer gir UCOM-deteksjon stabile og enkle å tolke resultater som passer bedre til en screeningprotokoll som krever mindre profesjonelt personell og medisinske ressurser.
Lett å oppdage
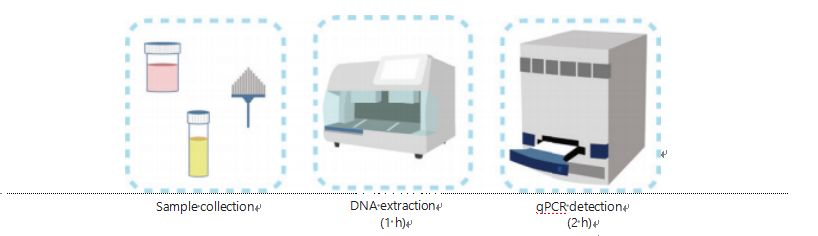
Nåværende metoder for DNA-metyleringsdeteksjon er kompliserte og tidkrevende.De fleste metodene krever bisulfitttransformasjon, noe som forårsaker tap i prøvekvalitet og muligens gir ustabile og unøyaktige resultater.Den dårlige reproduserbarheten forårsaket av bisulfittbehandling kan potensielt føre til forvirring for leger og pasienter og forstyrre oppfølgings- og/eller behandlingsstrategiene ytterligere.Derfor modifiserte vi metoden for UCOM-deteksjon ytterligere for å unngå problematisk bisulfittbehandling av prøvene, imøtekomme de kliniske applikasjonskravene og forbedre tilgjengeligheten.Vi utviklet en ny metode ved bruk av metyleringssensitive restriksjonsenzymer kombinert med sanntids fluorescerende kvantitativ PCR (Me-qPCR) for å kvantifisere metyleringsstatusen til UCOM-er innen 3 timer ved å bruke enkle håndteringsprosedyrer (Figur 3).Me-qPCR kan romme flere prøvetyper, for eksempel klinisk innsamling av kroppsvæsker og selvinnsamlede urinprøver.Innsamlede kliniske prøver kan behandles, lagres og enkelt fortsette til deteksjon ved hjelp av standardisert og automatisert DNA-ekstraksjon.Det ekstraherte DNAet kan deretter påføres direkte på Me-qPCR-plattformen for en en-pots reaksjon og utgangskvantifiseringsresultater.Etter enkel resultatanalyse ved bruk av diagnostiske modeller tilpasset og validert til spesifikke krefttyper, blir den endelige bestemmelsen av UCOM-deteksjonsresultater tolket og presentert som en semi-kvantitativ verdi.Me-qPCR-plattformen overgår den tradisjonelle bisulfitt-pyrosekvenseringen i UCOM-deteksjon mens den sparer 3 timers bisulfittkonvertering, i henhold til EZ DNA Methylation-Gold kit-protokollen.Den innovative plattformen for metyleringsdeteksjon gjør UCOM-deteksjon stabilere, mer nøyaktig og mer tilgjengelig30.
Figur 3 Deteksjonsprosess for UCOM-er.Prøvetyper inkluderer profesjonelt tatt BALF, Pap-børste og/eller selvinnsamlet urin.DNA-ekstraksjonsprosessen kan tilpasses til en automatisk ekstraktor, hvis produkt kan påvises direkte ved qPCR.
Anvendelse av UCOM
Lungekreft
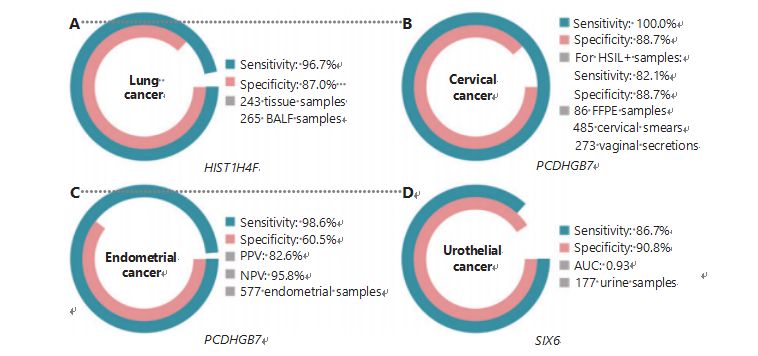
Lungekreft er den nest hyppigst diagnostiserte og mest dødelige kreften på verdensbasis, og står for 11,4 % av nye tilfeller og 18,0 % av nye dødsfall1.Blant alle diagnoser er 85 % ikke-småcellet lungekreft (NSCLC) og 15 % er småcellet lungekreft (SCLC), som har et høyere malignitetsnivå38.Lavdose computertomografi (LDCT)-skanning er den anbefalte screeningmetoden for lungekreft og har vist seg å forbedre tidlig oppdagelse og redusere dødelighet6;På grunn av lav spesifisitet og dårlig tilgjengelighet har imidlertid LDCT ennå ikke fungert som en tilfredsstillende screeningsmetode, i likhet med andre vanlige kreftmarkører, som CEA39.Kostnadene og potensialet for tapte diagnoser og feildiagnoser av LDCT-screeningsstrategien hindrer fremdriften av lungekreftscreening40.HIST1H4F, en UCOM, har et enormt potensial som en tidlig påvisningsbiomarkør i bronkoalveolær væske (BALF) prøver27.HIST1H4F er hypermetylert i lungeadenokarsinom og lungeplateepitelkarsinom, med en deteksjonsspesifisitet på 96,7 % og sensitivitet på 87,0 % (Figur 4A), og en eksepsjonell ytelse for stadium I kreftformer27.HIST1H4F har en spesifisitet på 96,5 % og en sensitivitet på 85,4 % for NSCLC, og henholdsvis 96,5 % og 95,7 % for SCLC27.I tillegg har prøver av åtte andre typer kreft, inkludert kreft i bukspyttkjertelen og tykktarmskreft, validert at HIST1H4F er hypermetylert i alle åtte typene27.
Livmorhalskreft
Livmorhalskreft var den fjerde hyppigst diagnostiserte kreftsykdommen og den fjerde ledende årsaken til kreftdødsfall hos kvinner i 2020, og sto for 3,1 % av nye tilfeller og 3,4 % av kreftrelaterte dødsfall globalt1.For å eliminere livmorhalskreft innen 2030, som foreslått av WHO, er tidlig oppdagelse av livmorhalskreft en nødvendighet.Hvis det oppdages på et tidlig stadium, når 5-års overlevelsesraten 92 % med invasiv livmorhalskreft41.Retningslinjene fra American Cancer Society (ACS) foreslår cervical cytologitester, primære HPV-tester eller co-tests for screening42.Cervikal cytologi er invasiv og kan bare oppdage 63,5 % av CIN2+-tilfellene37.
PCDHGB7, derimot, har prestert mye bedre ved bruk av celleprøver og vaginale sekreter, og kan effektivt skille HSIL fra LSIL i et ultra-tidlig stadium.PCDHGB7 alene har en sensitivitet på 100,0 % og en spesifisitet på 88,7 % for livmorhalskreft (Figur 4B), og en sensitivitet på 82,1 % og 88,7 % spesifisitet for HSIL+ prøver30.PCDHGB7 har også en 90,9 % sensitivitet og 90,4 % spesifisitet i vaginale sekresjonsprøver for livmorhalskreft, som er mye lettere å samle inn30.Når det kombineres med høyrisiko (hr) HPV-testen eller Thinprep Cytology Test (TCT), har PCDHGB7 en økt sensitivitet på 95,7 % og spesifisitet på 96,2 %, noe som er betydelig høyere enn hrHPV-testen (20,3 %), TCT (51,2 %). ), og de to kom sammen (57,8 %) for livmorhalskreft30.PCDHGB7 har også vist seg å være hypermetylert i 17 typer kreft fra TCGA-databasen, noe som indikerer dens egnethet i UCOM-familien30.
Figur 4 UCOM-er har blitt validert i fire typer kreft i store kliniske studier.A. Ytelse av HIST1H4F, en UCOM, i lungekreftdeteksjon av 508 prøver.B. Ytelse av PCDHGB7, en UCOM, i livmorhalskreftdeteksjon av 844 prøver.C. Ytelse av PCDHGB7, en UCOM, i endometriekreftdeteksjon av 577 endometrial Pap og Tao børsteprøver.D. Ytelse av SIX6, en UCOM, i urotelial kreftdeteksjon av 177 prøver.
EC
EC er en av de vanligste kreftformene for kvinnelige reproduksjonssystem over hele verden, med anslagsvis 4,2 millioner nye tilfeller og 1 % av kreftrelaterte dødsfall årlig1.Med en vellykket diagnose på et tidlig stadium, er EC helbredelig og har en 5-års overlevelse på 95 % for stadium I kreft.Pasienter som er symptomatiske, som unormal livmorblødning, får periodisk klinisk evaluering og gjennomgår invasive og smertefulle biopsiprosedyrer, til tross for at bare 5–10 % til slutt utvikler EC43.Transvaginal ultralyd, som den vanlige deteksjonsmetoden, er svært upålitelig på grunn av dens manglende evne til å skille godartede fra ondartede endometrielle forandringer og den høye antallet falske positive44.
En parallell sammenligning av serum CA-125, en bredt implementert EC-biomarkør, og PCDHGB7 ble utført.Serum CA-125 hadde en sensitivitet på 24,8 %, noe som tyder på at CA-125 er en utilstrekkelig markør for EC til tross for en spesifisitet på 92,3 %31.PCDHGB7-deteksjon ved bruk av Pap-børsteprøver ga en sensitivitet på 80,65 % og en spesifisitet på 82,81 % for ECatall-stadier, mens en Tao-børste hadde en sensitivitet på 61,29 % og en spesifisitet på 95,31 %31.Den diagnostiske modellen PCDHGB7, basert på Me-qPCR, ga en sensitivitet på 98,61 %, en spesifisitet på 60,5 % og en total nøyaktighet på 85,5 %, ved bruk av Pap- og Tao-børsteprøver (Figur 4C)31.
Urothelial kreft
Urothelial kreft, bestående av blære-, nyrebekken- og urinlederkreft, var den syvende hyppigst diagnostiserte kreften i 2020 på verdensbasis, og forårsaket 5,2 % av nye tilfeller og 3,9 % av dødsfallene1.Urotelkreft, hvorav mer enn 50 % er blærekreft, var den fjerde hyppigst diagnostiserte kreften i USA i 2022, og utgjorde 11,6 % av nylig diagnostiserte tilfeller3.Omtrent 75 % av blærekreft er klassifisert som ikke-muskelinvasiv blærekreft begrenset til slimhinnen eller submucosa45.En cystoskopibiopsi er gullstandarden for diagnostisering av urotelkreft implementert ved fluorescens in situ hybridisering (FISH) og cytologitester.FISK og cytologi har dårlig diagnostisk ytelse, og cystoskopi er påtrengende og har den underliggende risikoen for manglende mikrolesjoner, feiltolkning av lesjoner og potensielt forårsake spredning eller tilbakefall av kreft46.Den tidligere validerte UCOM, PCDHGB7, ble også vist å være hypermetylert i urotelial kreft, med et område under kurven på 0,86, noe som tyder på en potensiell diagnostisk evne30.For ytterligere å validere flere UCOM-er og bedre imøtekomme flere prøvetyper, ble SIX6, en ny UCOM, undersøkt og viste utmerket diagnostisk potensial i tidlig påvisning av urotelkreft ved bruk av urinprøver på Me-qPCR-plattformen.SIX6-deteksjon ved bruk av urinprøver viste en konkurransesensitivitet på 86,7 % og en spesifisitet på 90,8 % (Figur 4D), samtidig som den var ikke-invasiv og lett å anskaffe32.Potensialet til SIX6 i metastaseovervåking og evaluering av behandlingseffekt er for tiden under utredning.
Fremtiden og utfordringene
UCOM-er har en sterk ytelse i det diagnostiske potensialet for flere kreftformer, men det er mye arbeid igjen å gjøre.Vi har utvidet listen over UCOM-er og har aktivt validert UCOM-er i flere typer kreft, inkludert de som tradisjonelt er vanskelige å oppdage.Valideringsresultater fra TCGA-databaser har ytterligere bekreftet anvendelsen av UCOM-er i flere typer kreft og flere situasjoner.I en foreløpig undersøkelse har UCOM-er vist seg å ha et robust diagnostisk potensial for kolangiokarsinomer og bukspyttkjerteladenokarsinomer, som er nesten umulige å diagnostisere på et tidlig stadium med gjeldende screeningmetoder32,47.Evnen til å oppdage sjeldne kreftformer med UCOM-er kan utnyttes med sirkulerende tumor-DNA (ctDNA) av en forbedret flytende biopsiplattform48.En studie som involverte et plasma DNA-basert pan-cancer deteksjonspanel ga en sensitivitet på 57,9 %49.Til tross for den høye spesifisiteten, avslører den generelle ytelsen at det fortsatt er rom for forbedring.
De unike egenskapene til UCOM-er har også støttet undersøkelsen av UCOM-potensialet i evaluering av behandlingseffekt og overvåking av tilbakefall.I henhold til Response Evaluation Criteria in Solid Tumors (RECIST) er medisinsk bildediagnostikk den anbefalte metoden for residivovervåking og evaluering av behandlingseffektivitet, mens tumormarkører brukes alene for vurdering50.I virkeligheten påvirkes imidlertid avbildningstilnærminger sterkt av frekvensen og timingen, og utsetter derfor pasienter for høyere risiko og kostnader51,52.SIX6 har blitt validert for å tjene som en prediktor for brystkreftmetastaser32.Flytende biopsi-basert ctDNA-overvåking muliggjør sanntidsovervåking over minimale gjenværende sykdomsmåneder før radiologisk påvisning, ideelt sett forsinker og forhindrer tilbakefallsrelatert kreftprogresjon53.Foreløpige resultater tyder på at UCOM-er reflekterer nivået av krefthypermetylering i sanntid umiddelbart etter operasjon og behandling32.Den høye følsomheten som vises av UCOM-er og anvendeligheten i flere ikke-påtrengende prøvetyper gjør at UCOM-er kan tjene som en nøyaktig gjentaksovervåkingsbiomarkør samtidig som den opprettholder høy pasientkompatibilitet.
Samtidig er offentlig tilgjengelighet til testen en annen viktig sak som krever ekstra innsats.Mens UCOM-deteksjonssamarbeid har blitt tatt i bruk i flere sykehus i håp om å være til nytte for flere pasienter, har pro bono-deteksjoner og screeninger blitt aktivt utført på landsbygda i Kina.UCOM-er krever forbedret tilgjengelighet for å kvalifisere som et gjennomførbart screeningsverktøy, spesielt for underutviklede områder.
Mens UCOM-applikasjonens resultater i tidlig oppdagelse er lovende, finnes det mange ukjente om UCOM.Med aktiv leting er ytterligere forskning berettiget om hvorfor UCOM er universelt tilstede i kreft.De underliggende epigenetiske reguleringsmekanismene som ligger til grunn for UCOM-er er verdt å undersøke videre, noe som kan rettferdiggjøre en ny retning for kreftterapi.For å komme tilbake til samspillet mellom tumorhomogenitet og heterogenitet, er vi interessert i hvorfor UCOM-er kan være et unntak fra flertallet av kreftbiomarkører som er tett knyttet til spesifikke krefttyper.Rollen til UCOM-identifiserte DNA-metyleringsavvik i tumorgenese, tumorprogresjon og metastase har ikke blitt bestemt i prosessen med å miste og gjenvinne celleidentitet og krever en grundig inspeksjon.En annen stor interesse ligger i omfanget av inkorporeringen av homogenitetstrekket til UCOM med vevsunike markører i håp om å nærme seg presis påvisning av kreftspor og identifikasjon av tumorvevs opprinnelse på en omvendt måte.UCOM-er kan være et ideelt verktøy for å forebygge kreft, oppdage kreft og potensielt forsvare og eliminere kreft.
Gi støtte
Dette arbeidet ble støttet av National Key R&D Program of China (Grant No. 2022BEG01003), National Natural Science Foundation of China (Grant Nos. 32270645 and 32000505), et tilskudd fra Heilongjiang Provincial Health Commission (Grant No. 2020-111) , og et tilskudd fra Heze Science and Technology Institute (tilskudd nr. 2021KJPT07).
Erklæring om interessekonflikt
Wei Li er FoU-direktør for Shanghai Epiprobe Biotechnology Co., Ltd. Wenqiang Yu sitter i det vitenskapelige rådgivende styret til Epiprobe.W. Yu og Epiprobe har godkjent ventende patenter knyttet til dette arbeidet.Alle andre forfattere erklærer ingen konkurrerende interesser.
Forfatterbidrag
Utformet og designet prosjektet: Chengchen Qian og Wenqiang Yu.
Skrev oppgaven: Chengchen Qian.
Laget illustrasjonene: Chengchen Qian.
Har gjennomgått og redigert manuskriptet: Xiaolong Zou, Wei Li, Yinshan Li og Wenqiang Yu.
Referanser
1. Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al.Global Cancer Statistics 2020: GLOBOCAN estimater av
forekomst og dødelighet over hele verden for 36 krefttilfeller i 185 land.CA Kreft J Clin.2021;71: 209-49.
2. Xia C, Dong X, Li H, Cao M, Sun D, He S, et al.Kreftstatistikk i Kina og USA, 2022: profiler, trender og determinanter.Chin MedJ (eng.2022;135: 584-90.
3. Siegel RL, Miller KD, WagleNS, JemalA.Kreftstatistikk, 2023. CA Cancer J Clin.2023;73: 17-48.
4. Crosby D, BhatiaS, Brindle KM, Coussens LM, Dive C, Emberton M, et al.Tidlig oppdagelse av kreft.Vitenskap.2022;375: eaay9040.
5. Ladabaum U, Dominitz JA, KahiC, Schoen RE.Strategier for
kolorektal kreftscreening.Gastroenterologi.2020;158: 418-32.
6. Tanoue LT, Tanner NT, Gould MK, Silvestri GA.Lungekreftscreening.Am J Respir Crit Care Med.2015;191: 19-33.
7. Bouvard V, Wentzensen N, Mackie A, Berkhof J, Brotherton J, Giorgi-Rossi P, et al.IARC-perspektivet på livmorhalskreftscreening.N EnglJ Med.2021;385: 1908-18.
8. Xue P, Ng MTA, QiaoY.Utfordringene med kolposkopi for screening av livmorhalskreft i LMIC og løsninger med kunstig intelligens.BMC Med.2020;18:169.
9. Johnson P, Zhou Q, Dao DY, Lo YMD.Sirkulerende biomarkører i diagnostisering og behandling av hepatocellulært karsinom.Nat Rev Gastroenterol Hepatol.2022;19: 670-81.
10. Van PoppelH, Albreht T, Basu P, HogenhoutR, CollenS, Roobol M. Serum PSA-basert tidlig påvisning av prostatakreft i Europa og globalt: fortid, nåtid og fremtid.Nat Rev Urol.2022;19:
562-72.
11. HolyoakeA, O'Sullivan P, Pollock R, Best T, Watanabe J, KajitaY,
et al.Utvikling av en multipleks RNA-urintest for påvisning og stratifisering av overgangscellekarsinom i blæren.Clin Cancer Res.2008;14: 742-9.
12. Feinberg AP, Vogelstein B. Hypometylering skiller gener fra noen menneskelige kreftformer fra deres normale motstykker.Natur.1983;301: 89-92.
13. Ng JM, Yu J. Promoter hypermetylering av tumorsuppressorgener som potensielle biomarkører i tykktarmskreft.IntJ Mol Sci.2015;16: 2472-96.
14. Esteller M. Kreftepigenomikk: DNA-metylomer og histonmodifikasjonskart.Nat Rev Genet.2007;8: 286-98.
15. Nishiyama A, Nakanishi M. Navigering i DNA-metyleringslandskapet til kreft.Trender Genet.2021;37: 1012-27.
16. Xie W, Schultz MD, ListerR, Hou Z, Rajagopal N, Ray P, et al.Epigenomisk analyse av multilineage-differensiering av menneskelige embryonale stamceller.Celle.2013;153: 1134-48.
17. Li Y, Zheng H, Wang Q, Zhou C, WeiL, Liu X, et al.Genomomfattende analyser avslører en rolle til Polycomb i å fremme hypometylering av DNA-metyleringsdaler.Genom Biol.2018;19:18.
18. Koch A, JoostenSC, Feng Z, de Ruijter TC, DrahtMX, MelotteV,
et al.Analyse av DNA-metylering ved kreft: plassering på nytt.Nat Rev Clin Oncol.2018;15: 459-66.
19. KleinEA, Richards D, Cohn A, TummalaM, Lapham R, Cosgrove D, et al.Klinisk validering av en målrettet metyleringsbasert multi-kreft tidlig deteksjonstest ved bruk av et uavhengig valideringssett.Ann Oncol.2021;32: 1167-77.
20. Hanahan D, Weinberg RA.Kjennetegn på kreft.Celle.2000;100:57-70.
21. Hanahan D. Kjennetegn på kreft: nye dimensjoner.Kreft Oppdag.2022;12:31-46.
22. Schwartzberg L, Kim ES, Liu D, Schrag D. Presisjonsonkologi: hvem, hvordan, hva, når og når ikke?Am Soc Clin Oncol Educ Book.2017: 160-9.
23. Liu H, Meng X, Wang J. Kvantitativ metylering i sanntid
påvisning av PAX1-gen i livmorhalskreftscreening.IntJ Gynecol Cancer.2020;30: 1488-92.
24. Imperiale TF, RansohoffDF, Itzkowitz SH, Levin TR, Lavin P, Lidgard GP, et al.Multitarget-stool DNA-testing for kolorektal-kreftscreening.N EnglJ Med.2014;370: 1287-97.
25. Li J, Li Y, Li W, Luo H, Xi Y, Dong S, et al.Førerplassering
sekvensering identifiserer avvikende DNA-metyleringsmønstre som endrer celleidentitet og tumor-immune overvåkingsnettverk.Genom
Res.2019;29: 270-80.
26. Gao Q, LinYP, Li BS, Wang GQ, Dong LQ, Shen BY, et al.Ikke-påtrengende multi-kreftdeteksjon ved sirkulerende cellefri DNA-metyleringssekvensering (THUNDER): utvikling og uavhengige valideringsstudier.Ann Oncol.2023;34: 486-95.
27. Dong S, Li W, Wang L, Hu J, Song Y, Zhang B, et al.Histonrelaterte gener er hypermetylerte ved lungekreft og hypermetylerte
HIST1H4F kan tjene som en pan-kreft biomarkør.Cancer Res.2019;79: 6101-12.
28. HeijnsdijkEA, Wever EM, AuvinenA, Hugosson J, Ciatto S, Nelen V, et al.Livskvalitetseffekter av prostataspesifikk antigenscreening.N EnglJ Med.2012;367: 595-605.
29. LuzakA, Schnell-Inderst P, Bühn S, Mayer-Zitarosa A, Siebert U. Klinisk effektivitet av biomarkørtester for kreftscreening som tilbys som egenbetalingshelsetjeneste: en systematisk gjennomgang.Eur J Folkehelse.2016;26: 498-505.
30. Dong S, Lu Q, Xu P, Chen L, Duan X, Mao Z, et al.
Hypermetylert PCDHGB7 som en universell kreftmarkør og dens anvendelse i tidlig livmorhalskreftscreening.Clin Transl Med.2021;11: e457.
31. Yuan J, Mao Z, Lu Q, Xu P, Wang C, Xu X, et al.Hypermetylert PCDHGB7 som en biomarkør for tidlig påvisning av endometriekreft i endometriebørsteprøver og livmorhalsavskraping.Foran Mol Biosci.2022;8: 774215.
32. Dong S, Yang Z, Xu P, Zheng W, Zhang B, Fu F, et al.Gjensidig
eksklusiv epigenetisk modifikasjon på SIX6 med hypermetylering for sporing av forstadier til kreft og metastaser.Signal Transduct Target Ther.2022;7: 208.
33. Huang L, Guo Z, Wang F, Fu L. KRAS-mutasjon: fra undrugbar til druggable i kreft.Signal Transduct Target Ther.2021;6:386.
34. Belinsky SA, Nikula KJ, PalmisanoWA, MichelsR, SaccomannoG, GabrielsonE, et al.Avvikende metylering av p16(INK4a) er en tidlig hendelse i lungekreft og en potensiell biomarkør for tidlig diagnose.Proc Natl Acad Sci U SA.1998;95: 11891-6.
35. Robertson KD.DNA-metylering og menneskelig sykdom.Nat Rev Genet.2005;6: 597-610.
36. WentzensenN, Walker JL, Gold MA, Smith KM, ZunaRE,
Mathews C, et al.Flere biopsier og påvisning av livmorhalskreftforløpere ved kolposkopi.J Clin Oncol.2015;33: 83-9.
37. De Strooper LM, Meijer CJ, Berkhof J, Hesselink AT, Snijders
PJ, Steenbergen RD, et al.Metyleringsanalyse av FAM19A4
genet i livmorhalsskrap er svært effektivt for å oppdage livmorhalsen
karsinomer og avanserte CIN2/3 lesjoner.Kreft Forrige Res (Phila).2014;7: 1251-7.
38. Thai AA, Solomon BJ, Sequist LV, Gainor JF, Heist RS.Lungekreft.Lancet.2021;398: 535-54.
39. Grunnet M, Sørensen JB.Karsinoembryonalt antigen (CEA) som tumormarkør ved lungekreft.Lungekreft.2012;76: 138-43.
40. Wood DE, KazerooniEA, Baum SL, EapenGA, EttingerDS, Hou L, et al.Lungekreftscreening, versjon 3.2018, NCCN Clinical Practice Guidelines in Oncology.J Natl Compr Canc Netw.2018;16: 412-41.
41. American Cancer Society.Kreft fakta og tall.Atlanta, GA, USA: American Cancer Society;2023 [oppdatert 2023 1. mars;sitert 2023 22. august].
42. FonthamETH, Wolf AMD, Church TR, EtzioniR, Flowers CR,
Herzig A, et al.Livmorhalskreftscreening for personer med gjennomsnittlig risiko: 2020-retningslinjeoppdatering fra American Cancer Society.CA Kreft J Clin.2020;70: 321-46.
43. Clarke MA, Long BJ, Del Mar MorilloA, Arbyn M, Bakkum-Gamez JN, Wentzensen N. Sammenslutning av endometriekreftrisiko med postmenopausal blødning hos kvinner: en systematisk oversikt og meta-analyse.JAMA Intern Med.2018;178: 1210-22.
44. Jacobs I, Gentry-MaharajA, Burnell M, ManchandaR, Singh N,
Sharma A, et al.Følsomhet ved transvaginal ultralydscreening
for endometriekreft hos postmenopausale kvinner: en case-kontrollstudie i UKCTOCS-kohorten.Lancet Oncol.2011;12:38-48.
45. BabjukM, Burger M, CompératEM, Gontero P, MostafidAH,
PalouJ, et al.European Association of Urology Guidelines on ikke-muskelinvasiv blærekreft (TaT1 og Carcinoma In Situ) -
2019-oppdatering.Eur Urol.2019;76: 639-57.
46. Aragon-Ching JB.Utfordringer og fremskritt innen diagnostisering, biologi og behandling av uroteliale øvre kanal- og blærekarsinomer.Urol Oncol.2017;35: 462-4.
47. Rizvi S, KhanSA, Hallemeier CL, Kelley RK, Gores GJ.
Cholangiocarcinoma - utviklende konsepter og terapeutiske strategier.Nat Rev Clin Oncol.2018;15:95-111.
48. Ye Q, Ling S, Zheng S, Xu X. Flytende biopsi i hepatocellulær
karsinom: sirkulerende tumorceller og sirkulerende tumor-DNA.Mol Kreft.2019;18:114.
49. Zhang Y, Yao Y, Xu Y, Li L, Gong Y, Zhang K, et al.Pan-kreft
sirkulerende tumor-DNA-deteksjon hos over 10 000 kinesiske pasienter.Nat Commun.2021;12:11.
50. Eisenhauer EA, Therasse P, Bogaerts J, Schwartz LH, Sargent D, Ford R, et al.Nye responsevalueringskriterier i solide svulster: revidert RECIST-veiledning (versjon 1.1).Eur J Kreft.2009;45: 228-47.
51. LitièreS, Collette S, de Vries EG, Seymour L, BogaertsJ.RECIST - lære av fortiden for å bygge fremtiden.Nat Rev Clin Oncol.
2017;14: 187-92.
52. Seymour L, BogaertsJ, Perrone A, FordR, Schwartz LH, Mandrekar S, et al.iRECIST: retningslinjer for responskriterier for bruk i forsøk
testing av immunterapi.Lancet Oncol.2017;18: e143-52.
53. PantelK, Alix-Panabières C. Flytende biopsi og minimal gjenværende sykdom – siste fremskritt og implikasjoner for kur.Nat Rev Clin Oncol.2019;16: 409-24.
Siter denne artikkelen som: Qian C, Zou X, Li W, Li Y, Yu W. Utposten mot kreft: universelle markører kun for kreft.Cancer Biol Med.2023;20: 806-815.
doi: 10.20892/j.issn.2095-3941.2023.0313
Innleggstid: mai-07-2024